电话:15160017041邮箱:imtda321@qq.com

核心观点
医疗器械使用单位对需要定期保养和维护的医疗器械,应当按照产品说明书的要求进行保养、维护并予以记录,记录保存期限不得少于医疗器械规定使用期限终止后5年;否则,将面临责令改正、警告等行政处罚的风险。
一、案例引入
2023年5月23日,定兴县执法人员在某口腔诊所监督检查时发现该单位正在使用“牙科综合治疗机”,该单位当场不能提供上述医疗器械产品的维护、保养记录,执法人员于当日责令该单位于2023年5月30日前改正。 2023年6月1日,执法人员再次检查该口腔诊所时发现,该单位仍不能提供上述医疗器械的维护、保养记录,该单位未在规定期限内完成整改。行政机关作出罚款1万元的行政处罚决定。 来源:定市监处罚〔2023〕292号行政处罚决定书
二、相关执法依据
《医疗器械监督管理条例》 第五十条 医疗器械使用单位对需要定期检查、检验、校准、保养、维护的医疗器械,应当按照产品说明书的要求进行检查、检验、校准、保养、维护并予以记录,及时进行分析、评估,确保医疗器械处于良好状态,保障使用质量;对使用期限长的大型医疗器械,应当逐台建立使用档案,记录其使用、维护、转让、实际使用时间等事项。记录保存期限不得少于医疗器械规定使用期限终止后5年。 第八十九条 有下列情形之一的,由负责药品监督管理的部门和卫生主管部门依据各自职责责令改正,给予警告;拒不改正的,处1万元以上10万元以下罚款;情节严重的,责令停产停业,直至由原发证部门吊销医疗器械注册证、医疗器械生产许可证、医疗器械经营许可证,对违法单位的法定代表人、主要负责人、直接负责的主管人员和其他责任人员处1万元以上3万元以下罚款: …… (九)对需要定期检查、检验、校准、保养、维护的医疗器械,医疗器械使用单位未按照产品说明书要求进行检查、检验、校准、保养、维护并予以记录,及时进行分析、评估,确保医疗器械处于良好状态; ……
三、常见问题
牙科综合治疗机是第几类医疗器械?
牙科综合治疗机是第二类医疗器械,属于医疗卫生标准《医疗器械管理》中规定的中风降医疗器械。一般有两种结构形式:
①分体式牙科综合治疗机
特征:牙科治疗机与牙科椅相互分离
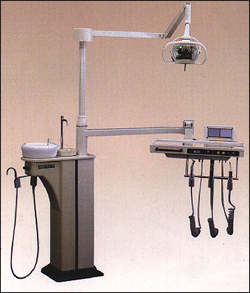
![]()
②连体式牙科综合治疗机
特征:牙科治疗机与牙科椅连成一体
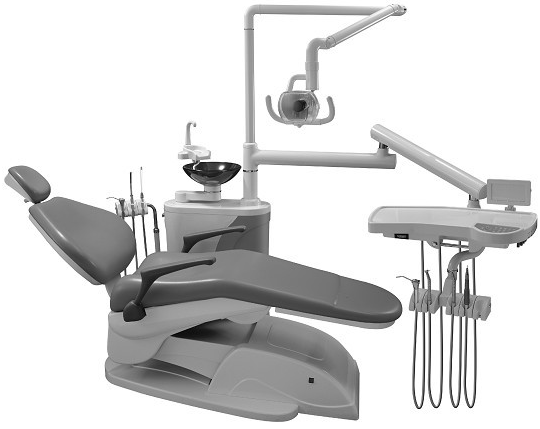
来源:《牙科综合治疗机注册技术审查指导原则》(2016年修订版)
谁负责医疗器械的维护保养?
根据《医疗器械临床使用管理办法》第十三条之规定,医疗器械使用科室负责医疗器械日常管理工作,做好医疗器械的登记、定期核对、日常使用维护保养等工作。
此外,《医疗器械安全管理》进一步规定,医疗器械管理部门负责组织医疗器械的检测、维护、维修,处理处理涉及安全与质量的技术问题;医疗器械使用部门应保证职责范围内的医疗器械维护保养和自我检查,协同医疗器械管理部门保障医疗器械的完好。
来源:《医疗器械安全管理》4.3.3d)及4.3.4c)
日常维护制度包括哪些内容?
(1)按照医疗器械说明书及随机技术文件的要求规定医疗器械检查、检验、校准的技术项目、标准值和周期,并明确具体责任人;
(2)日常维护性检验、检查、校准时应记录的事项与内容要求。
来源:《医疗器械安全管理》4.4.4
维护保养档案管理要求
预防性日常维护保养记录应当纳入管理性档案,医疗器械维护保养、维修记录应纳入技术性档案。管理性档案和技术性档案应保存至医疗器械使用终止后5年。
小贴士 医疗器械档案里都放啥?
根据《医疗器械安全管理》4.8的要求,档案资料包括技术性档案、管理性档案,档案资料应存放整齐,便于查找、核对,并分门类建立资料目录。 管理性档案应包括: (1)医疗器械台账;注册证书复印件、合格证明文件; (2)预防性日常维护保养记录; (3)医疗器械发生医疗损害事件报告与处理记录; (4)人员培训及考核记录; (5)应急调配记录; (6)医疗器械安全评价报告; (7)医疗器械处置文件。 技术性档案应包括: (1)供应商资质证明材料、注册证书复印件、合格证明文件; (2)临床使用前安装验收报告; (3)维修后检验、校准报告; (4)医疗器械维护保养、维修记录; (5)检验检测报告或证书; (6)医疗器械使用说明书; (7)维修作业指导书和操作规程。
高风险和大型医疗器械日常维护记录
根据《医疗器械安全管理》7.2.4的要求,医疗器械管理部门对每台高风险(对应《医疗器械监督管理条例》中的第三类医疗器械)和大型医疗器械应保证日常维护制度的执行,建立记录。记录内容应包括维护日期、维护人员姓名、维护具体项目、维护中发现的问题和采取的处理措施、维护后器械状态。记录文件应归档保存。
在文首案例中,医疗机构在行政机关第一次执法检查时不能提供医疗器械产品的维护、保养记录,在行政机关责令其在一定期限内改正后仍未完成整改,故被处罚款1万元。小编在此提醒大家,要重视行政机关的“责令整改”决定,避免受到更为严重的罚款处罚。
来源:友帆医事法
声明:转载的目的在于传递及分享更多信息,如涉及侵权,请及时联系我们,谢谢!
医工融合创新中心编辑:蒋琴(实习生)
医工融合创新中心审核:朱宗达
欢迎关注医工融合创新中心公众号,一起探讨学习交流。

