电话:15160017041邮箱:imtda321@qq.com

前言
2019年8月,国家药品监督管理局发布《国家药监局关于扩大医疗器械注册人制度试点工作的通知》,将医疗器械注册人制度试点扩大到21个省份,“解绑”医疗器械注册和生产。医疗器械注册人制度试点实施后,医疗器械研发外包服务从临床试验、注册环节延伸到研发、生产环节,医疗器械研发外包服务企业的业务范围进一步扩大。
医疗器械研发外包服务行业经过前期发展,已经成为医疗器械研发主体降低前期投入、加快注册申报进程、减少产品上市风险的重要战略选择。2019年,全国医疗器械研发外包服务市场规模达100亿元,预计未来年复合增长率将超过20%,医疗器械研发外包服务将成为医疗器械行业新的“蓝海”。
一、CRO和CDMO是核心支柱
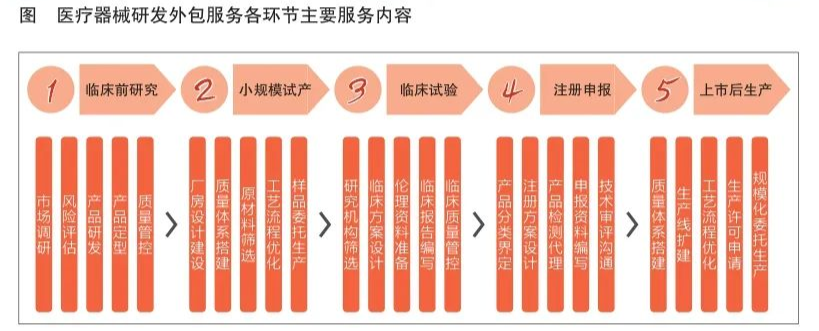
医疗器械研发外包服务涵盖临床前研究、小规模试产、临床试验、注册申报和上市后生产五个环节(见图)。医疗器械研发外包服务企业根据不同环节提供针对性服务,主要包括市场调研、风险管理、产品定型、厂房设计建设、工艺流程优化、临床试验方案设计、申报资料编写、规模化委托生产等。医疗器械研发外包服务企业包括医疗器械CRO(合同研究组织)与医疗器械CDMO(合同研发生产组织)两类。
医疗器械CRO主要是指通过合同形式向医疗器械研发主体提供产品临床研究服务的企业。临床试验是医疗器械CRO的核心服务,旨在帮助医疗器械研发主体加快临床试验进程,使其产品更快地进入注册申报环节。
医疗器械CDMO主要是指通过合同形式向医疗器械研发主体提供工艺研发设计、生产服务的企业。其业务主要集中在小规模试产和上市后生产环节,旨在帮助医疗器械研发主体提高质量管控水平、缩短试产周期、降低生产成本和提高生产效率。
医疗器械CRO和医疗器械CDMO的服务内容紧密相连,相互支撑,同时,二者之间也存在差别。前者侧重于发展研发能力,是技术密集型外包企业;后者则具有更高的准入门槛,高超的工艺技能与较大的资产规模是其提高市场份额的必备条件,属于技术密集型和资本密集型外包企业。
二、注册人制度释放需求
医疗器械注册人制度试点工作的开展,进一步释放了医疗器械研发外包服务市场需求。医疗器械研发主体可将实验室研发、小规模试产、规模化生产、质量质控等交给专业研发外包服务企业,医疗器械研发外包服务市场需求增量明显,将吸引更多企业入局,加快行业发展。
2019年8月,国家药监局将医疗器械注册人制度试点扩大到北京、河北、江苏等21个省(区、市)。截至2019年底,21个试点省份均已出台试点实施方案。医疗器械注册人制度试点范围的扩大,进一步激活了国内医疗器械研发外包服务市场,相关企业迎来发展契机。
梳理21个试点省份医疗器械注册人制度试点实施方案发现,对医疗器械研发外包服务行业影响较大的有质量管理、跨区域委托生产、信息化管理、注册人条件和医疗器械产业化五方面内容。
21个省份试点方案均鼓励第三方机构对注册人和受托人质量管理体系的运行情况及有效性进行评估。质量体系搭建是医疗器械研发外包服务企业的主要服务内容之一,注册人和委托人质量管理引入第三方机构成为外包企业业务增量主要来源之一。
跨区域委托生产能够进一步激活医疗器械生产要素的跨区域流动,上海、江苏、浙江、安徽等省份均允许注册人跨省委托生产。这意味着CDMO企业服务不再局限于本省范围内,今后可以将服务范围拓展到其他试点省份,提供样品生产和上市后产品的规模化生产服务。今年3月,上海、江苏、浙江、安徽三省一市联合发布《长江三角洲区域医疗器械注册人制度跨区域监管办法(试行)》方案,探索构建医疗器械跨省产业转移、分化重组、创新集聚、信息化监管新机制,促进跨省创新链、产业链协作,推动长三角地区形成特色化、规模化医疗器械产业集群。医疗器械研发外包服务龙头企业可以整合产业链资源,提升服务综合实力,服务的客户从单个企业提升到医疗器械产业集群,提供研发外包一体化服务。
信息化管理能够对产品全生命周期进行全流程追溯和监控,医疗器械研发外包服务企业可以凭借自身在研发工艺、研发流程、生产流程、产品质控等方面信息化管理优势,为客户提供高效的产品管理服务。此外,注册人制度实施后,科研人员等自然人也可成为医疗器械注册人,医疗器械研发外包服务企业可以开发C端客户资源,挖掘增量市场。
三、市场渗透率和增速提升明显
市场调研数据显示,我国医疗器械研发企业约20万家,若以医疗器械研发外包服务渗透率为10%、客均单价为50万元计算,我国医疗器械研发外包服务市场规模约为100亿元。
医院、高校等机构成为医疗器械研发外包服务行业下游市场新增主体。医疗器械注册人制度试点政策出台后,科研机构、高校、医院、科研人员等主体被允许通过委托的形式研发产品及进行产品上市后生产。随着医疗器械注册人制度试点工作的推进,试点地区科研机构、高校、医疗机构等主体将逐渐成为医疗器械研发外包服务企业的新增客户,带来研发、临床试验等服务需求的增加,行业将迎来新一轮增长。
医疗器械研发外包服务企业客户不断向境外医疗器械研发商扩展。根据《医疗器械监督管理条例》,向我国境内出口第二类、第三类医疗器械的境外生产企业,须由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,按照相关要求进行产品注册申报。同时,相关数据显示,2019年,国家药监局受理进口医疗器械注册申请5593项,相比2018年增长32%。进口医疗器械加速进入我国市场,为医疗器械研发外包服务行业带来市场增量。
医疗器械研发外包服务依托于医疗器械行业发展。数据统计,2018年,我国医疗器械市场规模已超5000亿元,预计2023年将突破万亿元。其中,骨科植入物、心血管植入物、体外诊断等医疗器械未来增速有望超过平均水平。
受人口老龄化、集中采购、进口替代等因素影响,骨科植入物市场未来年复合增长率将超过16%。骨科市场的良好发展态势,将吸引更多医疗器械企业加入,从而带动该领域医疗器械研发外包服务行业发展。
在政策鼓励下,心血管植入物、CT、核磁共振、彩超、内窥镜等高端医疗器械领域逐步打响“进口替代战”,未来市场增速有望超过其他医疗器械细分领域。高端医疗器械的价值与价格更高,企业在该领域开展业务更有助于提升核心竞争力。
体外诊断市场未来年复合增长率将达18%。细分领域中,免疫诊断、分子诊断和生化诊断市场规模最大,分别占体外诊断市场38%、20%、19%的份额。目前,医疗器械研发外包服务在体外诊断领域开展较多,相关企业可考虑延伸服务链,向研发设计、受托生产等环节发展。
综合来看,随着医疗器械市场的高速增长,在医疗器械注册人制度试点政策,以及医疗器械研发外包服务企业技术创新和模式创新的推动下,研发外包服务市场的渗透率和增长速度将进一步提升,未来年复合增长率有望超过20%。
四、握有更多市场主动权
医疗器械研发外包服务行业上游是提供医疗器械临床数据的医疗机构、医疗器械注册检验机构,议价能力较强。截至2019年12月31日,我国共有医疗器械临床试验机构834家,医疗器械注册检验机构数量约30家,且以政府检测机构为主,第三方医疗器械检测机构较少。而大多数医疗器械上市需要经过临床试验与注册检验环节,且每年新上市的医疗器械数量多,临床试验机构与医疗器械注册检验机构行业内部竞争较少,掌握更多市场话语权。
医疗器械研发外包服务下游市场是医疗器械研发主体,它们与医疗器械研发外包服务企业开展合作,可以减少前期投入,降低研发风险,提高研发效率,减少生产投入。因此,大部分医疗器械研发主体选择与外包服务企业合作,研发外包服务市场需求较大。
医疗器械研发外包服务是人才密集型、技术密集型行业,特别是大型医疗器械研发外包服务企业具备较强的专业能力,被替代的可能性较小。从业务范围来看,相比于医疗器械CRO服务,医疗器械CDMO服务潜在进入者的威胁更小。这是因为医疗器械CRO服务高度依赖人才,一旦新进入者有人才优势,就会对现有企业带来竞争压力;而医疗器械CDMO服务除了依赖人才外,还依赖于资金、实验室设备、生产设备等资源要素的投入,行业准入门槛较高。从各个细分领域看,低值医用耗材、体外诊断试剂等领域门槛较低,从事相关研发外包服务的企业多,竞争较为激烈;高值医用耗材、心血管植入、骨科植入等领域门槛高,能够满足要求的研发外包服务企业少,头部企业优势明显。
由此可见,医疗器械研发外包服务企业专业能力越强,被替代的可能性就越小,议价能力就越强,竞争者也就越少。
五、定位优势区域发展潜力大
大部分医疗器械研发外包服务企业在注册申报、临床试验等方面的服务范围覆盖全国,同时在经济发达地区和医疗器械产业集群地区设立子公司或办事处,承接当地业务,并覆盖周边地区;而研发设计、受托生产等服务,覆盖范围一般为车间或实验室所在地及周边2~3个省份。
国家药监局发布的《2019年度医疗器械注册工作报告》显示,2019年,国内注册的第二类、第三类医疗器械相关生产企业主要集中在经济相对发达省份。其中,就首次注册的境内第二类医疗器械来说,江苏、广东、浙江、河南、北京的注册数量共占全国的51.7%;江苏、北京、广东、上海、浙江是境内第三类医疗器械首次注册数量排前5位的省份,占2019年境内第三类医疗器械首次注册数量的69.1%。
与注册产品的地区分布情况相似,江苏、广东、北京、浙江、河南、上海等省份也是医疗器械研发外包服务企业竞争的主要阵地。巨翊科技、迈迪思创、泰格捷通、奥咨达、西格玛医学、德能医学、奥泰康、凌仕医疗等企业在江苏、北京、广东、上海等地均设有办事处或分公司。
此外,我国医疗器械各产业集群涉及的领域有所不同:粤港澳大湾区聚集医学影像设备、大型放疗设备、肿瘤热疗设备等相关研发生产企业,长三角产业带聚集一次性医疗器械和耗材、眼科设备、医学影像设备、射频肿瘤热疗设备等相关研发生产企业,京津冀环渤海湾产业带聚集医疗影像设备、计算机导航定位医用设备、呼吸麻醉机、骨科器材、心血管器材等相关研发生产企业。医疗器械研发外包服务企业可根据自身擅长或将要布局的重点领域,选择合适的产业聚集地开展相关业务。
六、高价值及新兴器械接受度高
医疗器械各细分领域对医疗器械研发外包服务的接受度不同,研发生产高价值医疗器械及耗材的企业对医疗器械研发外包服务的接受度较高,研发生产低价值医疗器械及耗材的企业对其接受度较低。
这是由于研发生产高价值医疗器械及耗材企业投入成本高,对技术和科研人才的要求较高,自主进行研发、临床试验、产品生产的风险也较高,而研发外包企业恰好在这些方面具备较强的专业优势。因此,研发生产高价值医疗器械及耗材的企业对外包服务的接受度更高,付费意愿也更强。研发生产低价值医疗器械及耗材的企业则情况相反。
心血管介入、骨科介入、神经介入、体外诊断、大型影像诊断等领域高价值医疗器械及耗材品类较多,研发外包服务需求强劲,大部分医疗器械研发外包服务企业的业务会涉及这些领域。
此外,在人工智能、手术机器人、3D打印等新兴领域开展研发外包业务的企业数量也在逐渐增多。这些新兴领域产品的临床需求增长较快,且技术门槛较高,研发企业为加快产品上市步伐,会倾向采取研发外包形式。而眼科、齿科、整形美容等领域对技术、人才等方面的要求较低,研发生产、临床试验风险也较低,企业研发外包需求较弱,涉足这些领域的研发外包服务企业相对较少。
七、人才短缺痛点待除
医疗器械研发外包服务行业前景广阔,但也存在一些发展痛点。首先是专业人才匮乏。医疗器械研发外包服务行业对专业人才的要求高,相关人才需要精通法学、医学、经济学、管理学等多个学科知识,涉及研发服务、临床试验服务相关人才,需要精通医药、机械、电子、塑料、软件等多个行业。
医疗器械研发外包服务行业是多学科交叉、知识密集型高技术行业,高校应届毕业生需要经过职业培训、实践教育等长期培养,才能具备相关能力。市场上已有的复合型人才具有较强的竞争力,医疗器械研发外包服务企业需要与投资机构、医疗器械企业、医药企业等机构“抢夺”优秀人才。同时,随着研发外包服务企业数量日益增多,对相关人才的需求量大幅增加,行业人才缺口加大。
专业人才匮乏是阻碍医疗器械研发外包服务行业发展的核心痛点。部分企业通过创新人才管理机制来解决这一问题,如迈迪思创打造人才培养体系与人才激励体系,积极培育相关人才,为企业发展储备人才资源。
其次是急需复合型人才。医疗器械种类繁多,每种医疗器械都有其独特的技术要求。医疗器械研发外包服务企业需要具备复合型研发人才,并投入多种研发设备以提升研发能力,满足各种医疗器械的研发外包服务需求。
最后是委托关系还需进一步规范。医疗器械注册人制度规定委托方要转移相关技术文件给受托方,但委托方与受托方的合作还受到商业信任、知识产权保护等因素的影响。目前,委托方与受托方多为关联公司,如深圳迈普再生医学科技有限公司作为全资子公司委托广州迈普再生医学科技有限公司生产颅颌面修补系统,上海微创电生理医疗科技股份有限公司委托全资子公司上海远心医疗科技有限公司生产单道心电记录仪。随着医疗器械注册人制度的不断落地,相关政策不断出台,商业合作将更加广泛。
转自动脉网

